心情随笔
20230407_CRISPR文库全基因组筛选方法

CRISPR文库全基因组筛选
CRISPR文库全基因组筛选是利用CRISPR技术对整个基因组进行筛选的一种方法。这种方法旨在鉴定与特定细胞功能或表型相关的基因或遗传序列。在这种筛选方法中,使用CRISPR-Cas9或其他CRISPR系统,设计一组引导RNA(gRNA)以靶向性地引导Cas9酶切割基因组中的不同位点。这样可以在大量细胞中引起基因敲除、编辑或靶向重组,并对细胞进行分析,以确定哪些基因对于特定功能或表型具有关键作用。CRISPR文库全基因组筛选可以分为两种类型:正向筛选和负向筛选。正向筛选是针对特定功能或表型寻找关键基因,而负向筛选则是通过剔除那些影响特定功能或表型的基因来寻找关键基因。这种筛选方法在基因功能研究和药物开发等领域中广泛应用。通过对大规模的基因组进行筛选,可以发现新的基因及其与疾病和生理过程的关系,从而为新药物的发现提供有力支持。
CRISPR 筛选有助于发现引发特定细胞类型特定功能或表型的关键基因或基因序列。像所有优秀的科学实验一样,CRISPR 筛选实验在设计时就考虑了一个假设,但与许多实验不同的是,假设不是一个狭隘的假设。所有的 CRISPR 筛选实验都有一个广泛的假设,即基因组中存在少数具有一定生理效应的基因序列或基因,而这少数基因序列可以被识别出来。成功实验的结果是一份候选基因或基因序列的简短列表,这些候选基因或基因序列似乎参与了所研究的生理效应的产生。因此,CRISPR 筛选实验不仅以广泛的假设开始,而且以产生新的、狭隘的假设结束。也就是说,通常需要使用其他生物学方法进一步研究每个已识别的基因或基因序列,以确定它是否真的产生了所研究的效果。许多研究人员使用 CRISPR,它是一种在 DNA 中的特定目标位点进行双链切割的方法。当细胞中的基因组 DNA 产生此类切割时,细胞会使用其 DNA 修复系统来修复切割。通常,修复过程是不精确的,它会导致敲除目标基因的突变。这种敲除事件是科学家在大多数 CRISPR 筛选实验中想要的主要结果。
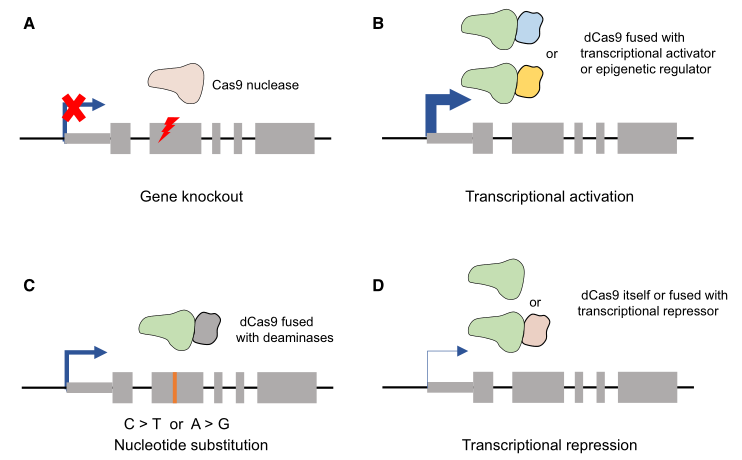
图1 CRISPR-Cas9系统在基因组中的应用。a 野生型Cas9在靶位点引发双链DNA断裂(DSBs),这些DSBs通过细胞内的DNA修复机制进行修复,导致插入/缺失(indels),从而引起功能丧失突变。 b、c 通过与转录调节因子(激活子和抑制子)或表观遗传调节因子结合,可以使用dCas9进行靶向转录调节。 d 可以将dCas9与胞嘧啶或腺嘌呤脱氨酶融合,以引入靶向核苷酸替换。
CRISPR筛选的用途示例:
除了在细胞中寻找引起耐药性或药物敏感性的基因外,CRISPR 筛选还用于许多其他情况 。例如,它已被用于鉴定在线粒体代谢和溶酶体功能中重要的基因。通过与转录激活剂结合的催化死亡 Cas9 酶,CRISPR 筛选已被用于启动数千个长非编码 RNA (lncRNA) 的表达,以识别那些参与调节黑色素瘤细胞耐药性的分子。其他筛选项目使用催化死亡的 Cas9 与转录激活剂结合以开启大量基因的表达,也使用不使用转录激活剂从而抑制许多基因的表达。CRISPR 筛选的另一种方法包括在文库中对每个慢病毒使用两个不同的靶向序列,这种方法具有多种应用,从在筛选中使用 Cas9 切口酶到在大型筛选项目中删除大量基因组 DNA 片段。大多数实验室在动物身上实施大型 CRISPR 筛选是不切实际的,因为这可能需要大量动物,每个动物都携带不同的基因突变进行单个实验。然而,一些 CRISPR 筛选方法已用于动物。例如,在一个项目中,一种通常不会转移的小鼠癌细胞系用包含超过 67,000 个慢病毒的 CRISPR 文库进行处理。然后将癌细胞移植到小鼠体内。肿瘤生长和转移。通过对转移灶中的 DNA 进行测序,研究人员确定了几个 CRISPR 靶向基因。这表明这些基因的功能丧失可能导致肿瘤的生长和转移。
- 基因功能研究:CRISPR筛选可以帮助研究人员识别与特定生物过程或疾病相关的基因,并研究这些基因的功能。例如,使用CRISPR筛选可以鉴定对癌细胞增殖和转移至其他组织的关键基因。
- 药物发现:CRISPR筛选可用于筛选具有治疗潜力的新药物靶点。通过CRISPR筛选可以鉴定可能与特定疾病有关的基因,并研究这些基因与药物靶点之间的关系。鉴定导致细胞对药物表现出抗性或敏感性的基因或DNA序列。
- 农业基因编辑:CRISPR筛选可用于鉴定可能影响农作物产量、抗病性和耐旱性等性状的基因。例如,使用CRISPR筛选可以鉴定可能影响水稻产量的关键基因。或鉴定影响细胞对环境毒素易感性的基因或DNA序列。
- 合成生物学:CRISPR筛选可用于构建合成途径和调控系统。例如,使用CRISPR筛选可以鉴定对生物合成途径中关键步骤有影响的基因,以及对基因表达和调控有重要作用的调节元件。
CRISPR 筛选是工作原理:
CRISPR 筛选的基本思想是剔除每个可能重要的基因,但每个细胞只剔除一个基因。预期的结果是在培养皿中形成一个细胞群,其中每个细胞都敲除了不同的基因。一些细胞会死亡,但其他细胞会存活,甚至生长得更好并成为主要的细胞类型。在允许敲除细胞生长几天后,对整个混合细胞群进行下一代测序 (NGS),以确定哪些序列存在,哪些序列已耗尽或不存在。这样的实验确定了在正常条件下生存所必需的基因序列。然而,大多数 CRISPR 筛选研究的另一个目标是鉴定允许细胞在特定条件下存活的基因,例如药物治疗或其他感兴趣的生理条件。
因此,在大多数 CRISPR 筛选实验中,都存在需要更好地了解的特定生理情况。例如,癌细胞系可能对某些药物具有抗性。该药物会杀死其他细胞,但不会杀死这种癌细胞系。科学家通常从可能与这种耐药性有关的数千个基因或基因序列的列表开始,并旨在通过 CRISPR 筛选缩小该列表的范围。通常,筛选以基因组中所有基因的列表开始,以确保没有遗漏任何内容。
从基因或基因序列列表中,科学家们然后生成一长串 CRISPR 目标。这些靶标是约 20 个碱基的 DNA 序列,位于基因组中,与称为原型间隔区相邻基序 (PAM) 的位点相邻。对于 CRISPR 筛选,必须剔除所有正在研究的基因。因此,为了增加切割的可能性,必须为每个正在研究的基因或基因序列选择几个目标位点。推荐每个基因大约 选择6-8 个目标位点 。
一旦确定了目标序列和控制序列,下一步通常是设计一个用于制造慢病毒的寡核苷酸库。一些研究人员转而使用腺相关病毒,但这并不常见。对于常用的池方法,池中的每个寡核苷酸都必须包含至少编码 CRISPR 向导的靶向区域的 DNA,或者通常是包括目标序列的整个单向导 RNA (sgRNA) [7]。每个寡核苷酸还必须在每一端都有位点,以便克隆到为生物安全而适当设计的包含慢病毒基因的质粒中。从质粒中,慢病毒被生产为一个包含数千个 CRISPR 靶向序列的库,每个病毒颗粒(病毒体)有一个靶向序列。
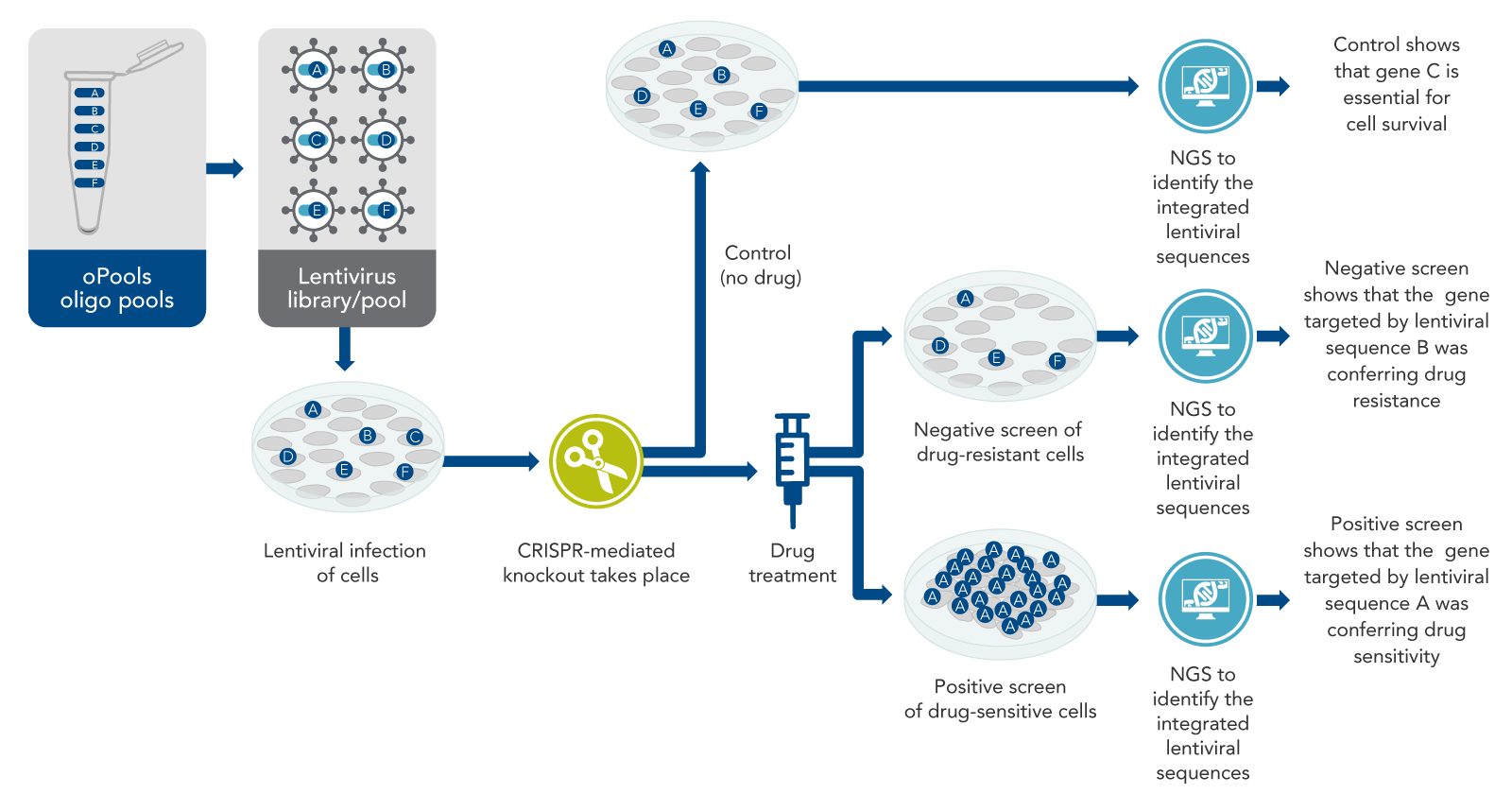
图2. 使用DNA寡核苷酸池的CRISPR筛选。使用CRISPR gRNA的寡核苷酸池制备一系列慢病毒文库,以破坏大量基因。CRISPR基因组编辑会在不同的细胞中敲除不同的基因。接着,使用下一代测序来确定哪些基因已经被破坏,哪些没有被破坏。可以鉴定出与药物耐药性或敏感性相关的基因;负筛选确定导致耐药的基因,而正筛选确定导致敏感的基因。
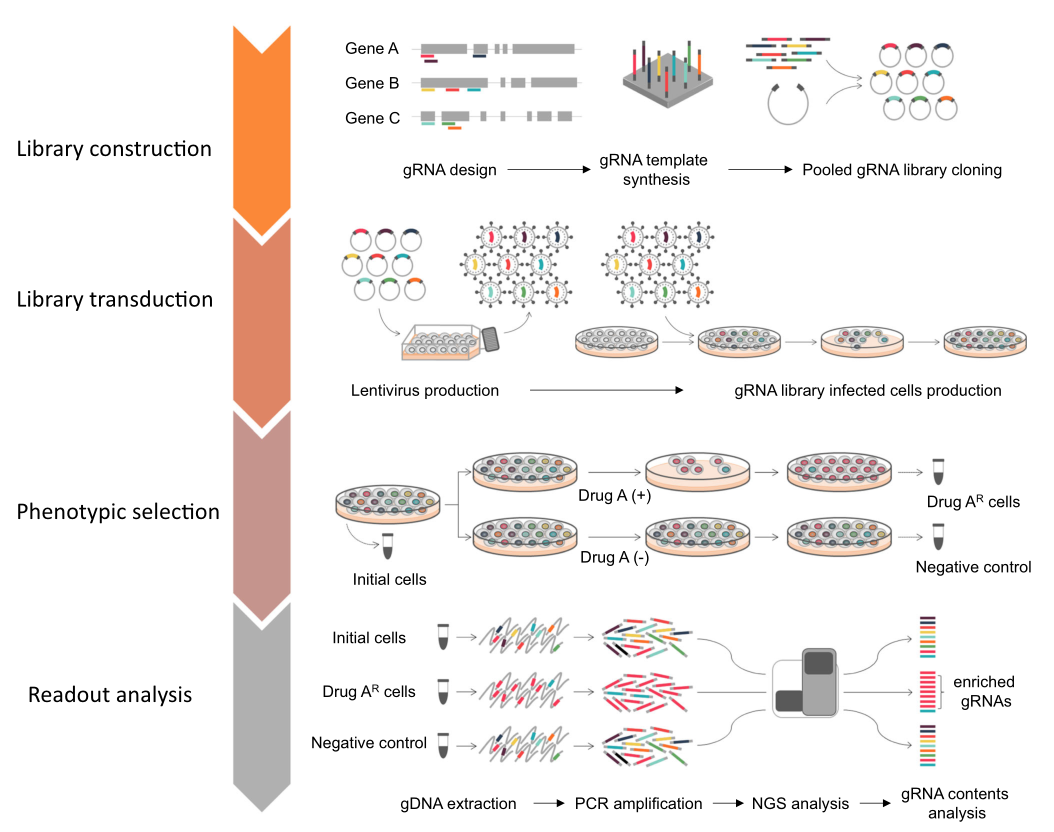
CRISPR-Cas9混合库筛选在哺乳动物细胞中通过一系列步骤进行,包括库构建、慢病毒转导、细胞筛选和读出分析,这与基于RNAi的混合库筛选类似。首先,在计算机中为特定目的设计CRISPR混合库。可以使用几个工具来识别目标基因组区域的gRNA。通常,CRISPR混合库包含多个针对每个基因的gRNA,这些gRNA序列用作库筛选读出的条形码。合成含有设计的gRNA编码序列的混合寡核苷酸,并用适当的载体生成CRISPR混合库,从而得到混合质粒DNA库。接下来,从质粒DNA库制备慢病毒颗粒,并转导到哺乳动物细胞进行生物学筛选。在表型选择(如耐药或毒素抗性)后,通过下一代测序(NGS)分析筛选的读出,显示特定gRNA的平均富集或耗减。特定gRNA的显著富集或耗减表明gRNA所靶向的基因与感兴趣的表型之间存在功能关联。已经开发了许多不同的算法,用于利用CRISPR混合库筛选结果分析富集或耗减的gRNA、基因和细胞通路。
CRISPR 文库使用方法:
“CRISPR 文库”一词经常与“CRISPR 指导 RNA 文库”或“sgRNA 文库”等术语互换使用。几乎在所有情况下,这个“RNA 库”实际上就是从寡核苷酸库中产生的一批慢病毒!因此,这样的文库实际上并不是免费的 RNA,即使人们称它为“RNA 文库”。慢病毒确实是 RNA 病毒,因此文库中的每个慢病毒都包含 RNA,但这不是 CRISPR 引导 RNA。这是病毒RNA,对于Cas酶用于基因组编辑来说太长了。当慢病毒文库感染细胞时,CRISPR 不会立即开始,因为还没有 CRISPR 指导 RNA。相反,慢病毒 RNA 首先被逆转录为 DNA,然后将其整合到受感染细胞的基因组中。这种整合可以发生在细胞基因组中数百个位点中的任何一个。这些位点与 CRISPR 靶位点无关,但这种整合却可能影响插入位点周围基因的功能。
在 CRISPR 慢病毒筛选实验中,科学家的目标是用每个细胞不超过一个病毒粒子来感染细胞。为了实现这一点,通常使用非常小的病毒粒子与细胞比率,或感染复数 (MOI),范围为 5-30%。由于文库中的每个慢病毒都包含来自寡核苷酸库的一个序列,因此将一个这样的序列作为 DNA 整合到每个受感染细胞的基因组中。整合后,慢病毒序列,包括克隆的 CRISPR 序列,被转录成 RNA。因此,在使用慢病毒文库感染细胞后,最终会产生 CRISPR 向导 RNA。
细胞中表达Cas酶的两种策略:
细胞必须表达 Cas(CRISPR 相关)酶才能使 CRISPR 筛选发挥作用。CRISPR 引导 RNA 将 Cas 蛋白引导至目标位点。然后,Cas酶切割DNA。 科学家使用多种方法将 Cas 酶传递到细胞中进行 CRISPR 筛选,包括:(1)使用稳定表达 Cas 酶的细胞系。这种细胞系通常是在开始慢病毒 CRISPR 文库筛选之前的一段时间,使用携带所需 Cas 酶基因的单独慢病毒预先产生的。(2) 生产包含所需 Cas 酶基因和编码引导 RNA 的 DNA 的慢病毒库。
在 CRISPR 筛选中使用慢病毒:
慢病毒具有潜在的危险性,必须采取适当的安全措施,那么为什么它们在 CRISPR 筛选中如此受欢迎?如上所述,慢病毒将其 DNA 稳定地整合到哺乳动物基因组中。此功能用于 CRISPR 筛选,如下所示。当受慢病毒感染的细胞存活时,它们会整合慢病毒基因组,包括已克隆到慢病毒基因组中的约 20 个 CRISPR 靶向碱基。即使在目的基因被敲除后,细胞仍会继续携带这些指导序列并表达相应的 CRISPR RNA (crRNA)。当细胞增殖时,连续几代细胞携带编码向导 RNA 的慢病毒 DNA。这很有用,因为可以对来自细胞的 DNA 或 RNA 进行测序,因此科学家们可以找出每个细胞包含的 DNA/RNA 序列。在某些细胞有机会增殖而其他细胞被杀死之后,这种 DNA 或 RNA 的持续表达是 CRISPR 筛选中所测量的。
负向筛选和正向筛选:
耐药性和药物敏感性是 CRISPR 筛选经常研究的两个主要生理反应。阴性筛选用于寻找引起耐药性的基因,阳性筛选用于寻找引起药物敏感性的基因。这些方法非常相似,但结果不同。
阴性筛选:回到对特定药物具有抗性的癌细胞系的例子,筛选是如何工作的?如果首先对耐药癌细胞系进行 CRISPR 筛选,然后用药物治疗(通常不会杀死细胞,因为它们具有耐药性),其中一些癌细胞实际上会因药物反应而死亡。这表明抗性基因被敲除。该实验的对照是使用相同慢病毒库靶向但未用药物处理的细胞。这是必要的,因为如果某些细胞中的必需基因被敲除,即使没有药物,这些细胞也会死亡。从无药物对照细胞中会检测到许多序列,因为这些细胞中的大多数都能存活。然而,对于实验样品(药物处理的细胞),敲除抗性基因的靶序列将无法通过测序检测到。缺失的序列很有可能靶向了耐药基因。这称为负向筛选。为了证实阴性 CRISPR 筛选的结果,通常会进行其他类型的生物学研究。
阳性筛选:对特定药物敏感的细胞类型会被药物自然杀死。为了鉴定赋予敏感性的基因,科学家们可以使用针对抗性癌细胞系所描述的相同方法。在这种情况下,屏幕中的一些引导 RNA 可能会敲除导致药物敏感性的基因。未编辑的细胞(它们是 CRISPR 筛选后但药物治疗前的大部分细胞,因为 MOI 小于 30%)将被药物杀死。此外,大部分 CRISPR 编辑的细胞也会被杀死,因为基因组中的大多数基因都不是药物敏感基因。只有少数细胞,即那些药物敏感性基因被敲除的细胞,会生长。在药物存在的情况下,这些细胞的增殖远远超过其他细胞,并可能接管整个群体。NGS 测序将显示编码用于删除敏感性基因的引导 RNA 的 DNA 的存在。这种 DNA 会大量存在,因为携带这种 DNA 的细胞已经增殖,因为它们的敏感性基因已经被敲除。这称为阳性筛选。
参考资料
======================
https://zhuanlan.zhihu.com/p/428166580
https://link.springer.com/article/10.1007/s12272-018-1029-z


